Unidad 3
LA ENVOLTURA DE LOS ÁTOMOS
La determinación de la disposición de los electrones alrededor del núcleo atómico ha sido un inmenso logro de científicos de las Matemáticas, la Física y la Química. Los resultados de las investigaciones muestran aspectos sorprendentes de la naturaleza de la materia y la energía. Estos aspectos, en relación al átomo, permiten fundamentalmente la comprensión del comportamiento químico de las sustancias.
LAS ONDAS ELECTROMAGNÉTICAS Y LA ENERGÍALas ondas electromagnéticas son campos eléctricos (E) y magnéticos (H) variables, oscilantes y mutuamente perpendiculares que se desplazan por el espacio y se relacionan íntimamente con el concepto de energía
MAGNITUDES Y CUALIDADES DE LAS ONDAS
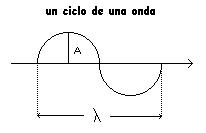
c = velocidad de propagación de la onda ( cm/ seg)
= longitud de onda ( lambda) desplazamiento del frente de onda en un ciclo (cm)
T = Período ( tiempo de un ciclo ) (seg)
= frecuencia ( nu ) = 1/T seg –1 = ciclos/seg = Hertz
Ecuación fundamental = c T
_
EL ÁTOMO DE HIDROGENO DE BOHR
(Principios Básicos de Química H.Gray)
1) Orbitas circulares
2) Momento angular = m e v r = n h / 2 n = 1,2,3...........
n = Número cuántico principal.
Se asocia al tamaño y energía de los orbitales
¿Cuántos valores? Infinito
¿Cuáles? 1,2 3,4,.............. ( Es el mismo n del átomo de Bohr)
l = Número cuántico secundario
Se asocia al tipo o forma de los orbitales
¿Cuántos valores? n
¿Cuáles? 0, 1, 2, 3, .........(n-1)
s p d f
Cada uno de los cuatro primeros valores se asocian respectivamente a las letras que se indican.
m = Numero cuántico magnético.
Se asocia con la orientación espacial de los orbitales
¿Cuántos valores? 2l +1
¿Cuáles? - l, - ( l-1 ), .... -1, 0, 1, ......+ ( l-1 ), + l
s = Numero cuántico de spín electrónico.
Se asocia al giro del electrón sobre su eje
¿Cuántos valores? 2
¿Cuáles? - 1 / 2 , + 1 / 2
GRÁFICOS DE ORBITALES
Ante la imposibilidad de resolver la ecuación de Schorodinger para sistemas de varios electrones, se ha supuesto y con éxito, que sucesivos electrones adoptarán los diversos modos de vibración que se encontraron para el electrón de átomo de Hidrógeno.
En palabras más simples, los sucesivos electrones se ubicaran en los orbitales ya determinados para el átomo de Hidrógeno y de acuerdo a las siguientes reglas.
Principio de exclusión de Pauli
Principio de Estabilidad o menor Energía
Regla de Ta o de las diagonales.
Los electrones se ubican primero en los orbitales de menor energía.
Son de menor energía los de menor valor de n + l.
A igualdad de n + l se considera de menor energía los de menor n.
Principio de Hund
En el caso de varios orbitales de igual energía o "degenerados" ( igual n + l , igual n ), por ejemplo una serie de 3 orbitales p, o una serie de 5 orbitales d, o bien una de7 orbitales f. Los electrones entran de a uno en cada uno de ellos, haciéndolo primero, por convención, con spin negativo. Cuando todos los orbitales " degenerados" ya hayan recibido un electrón con spin negativo pueden formarse parejas de spines opuestos.
Unidad 4
PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS
La repetición de las configuraciones electrónicas y la consiguiente conformación de un sistema de períodos y grupos es el fenómeno de carácter periódico más relevante. Sin embargo, hay otras propiedades atómicas importantes afectadas de carácter periódico.Es la Energía que se necesita para arrancar el electrón periférico a un átomo neutro libre.
A 0 (g) + POTENCIAL DE IONIZACIÓN = A+ 1 (g) + e-
Mientras más cercano al núcleo, el electrón periférico es atraído con mayor fuerza y viceversa. En consecuencia la magnitud de la Energía de Ionización se comporta en forma inversa a la del Radio Atómico.
LA ELECTROAFINIDAD ( E . A .)
Es la Energía que se libera cuando un átomo libre y neutro capta un electrón.
A 0 (g) + e- = A-1 (g) + ELECTROAFINIDAD
Mientras más cercano al núcleo, el electrón periférico es atraído con mayor fuerza y viceversa. En consecuencia la magnitud de la Electroafinidad se comporta en forma inversa a la del Radio Atómico .
No cuenta para los gases nobles
LA ELECTRONEGATIVIDAD ( E. N.)
La Electronegatividad es una magnitud que engloba tanto al P.I como a la E.A. y, en consecuencia, es proporcional a ambas. De la misma forma que las magnitudes anteriores se comporta en forma inversa al Radio Atómico
Mide la tendencia a formar iones negativos o bien la capacidad de atraer electrones.
La electronegatividad máxima es la del Fluor e igual a 4. No cuenta para los gases nobles.
LA ELECTROPOSITIVIDAD ( E . P .)
La Electro positividad es una magnitud de sentido inverso de la E. N.
Mide la tendencia a formar iones positivos o bien la capacidad de perder, ceder o repeler electrones.
Tampoco cuenta para los gases nobles
LA FORMACIÓN DE LAS MOLÉCULAS
La formación de los iones o bien alcanzar ciertos estados de oxidación hay que observarlo como un proceso asociado entre distintos átomos y que conduce a la formación de las moléculas de las diferentes Sustancias Puras. Las fórmulas (atomicidades) de aquellas moléculas puede deducirse teniendo en cuenta el estado de oxidación de los iones estabilizados y fundamentalmente la necesidad que la estructura molecular resultante sea eléctricamente neutra. La atomicidad de un elemento se obtiene tomando en primer término el valor absoluto del estado de oxidación del átomo del otro elemento y viceversa, luego aquellas atomicidades se simplifican, de ser posible, llegándose a las definitivas.
M+m n N -n m
M = Metal N = No Metal
TIPOS DE COMPUESTOS FUNDAMENTALES
SU OBTENCIÓN FORMAL Y DENOMINACIÓN ACTUAL Y ANTIGUA
OXIDOS METALICOS
M 0 + O 0 2 ________ > M +m 2 O –2m
Ejemplos: Cu +12 O –2 Oxido de cobre I , antes Oxido cuproso
Cu +2 O –2 Oxido de cobre II , antes Oxido cúprico
OXIDOS NO METALICOS ( antes ANHIDRIDOS)
N 0 + O 0 2 _________> N +n2 O –2n
Ejemplos: C +2 O –2 Oxido de carbono II , antes Anhidrído carbonoso
C +4 O –22 Oxido de carbono IV, antes Anhidrído carbónico
Como se puede observar, la denominación antigua que es muy persistente, depende del Número de Oxidación con que interviene el elemento. Esta nomenclatura usa prefijos y terminaciones alrededor de la raíz del nombre del elemento de acuerdo al número de estados de oxidación que posee el elemento y a la posición, entre éstos, del número de oxidación en uso.
LOS HIDRÓXIDOS (OXIDO METÁLICO+ AGUA)
M +m2 O -2m + m H+12 O-2 = 2 M+m ( O-2 H+1)m
Ejemplo:
Al +32 O -23 + 3 H+12 O-2 = 2 Al+3 ( O-2 H+1)3 ( Al ( OH)3 )
Oxido de Aluminio Hidróxido de Aluminio
LOS OXÁCIDOS ( OXIDO NO METÁLICO + AGUA)
N +n 2 O -2n + H+12 O -2 = H+12 N+n2 O-2n+1
Ejemplo:
S+6 O-2 3 + H+12 O–2 = H+12 S+6 O-24 ( H2 S O4 )
Anhídrido Sulfúrico Acido Sulfúrico
LOS HIDRÁCIDOS (HIDROGENO +NO METALES)
n H 02 + N 02 = 2 H+1n N – n
Ejemplo:
n H 02 + S 02 = 2 H+12 S – 2 ( H2 S )
Acido Sulf hídrico
LOS ÁCIDOS Y LAS BASES
Mejor que un nuevo tipo de compuestos habría que señalar que son compuestos que poseen una propiedad relacionada a la reacción de disociación del agua y a los iones que allí son liberados:
H2O
H2O = H + + OH –
ión hidrógeno ión hidroxilo
ACIDOS son sustancias de fórmula general HA que se disocian en agua liberando el ión hidrógeno
H2O
HA = H + + A –
ácido ión hidrógeno anión del ácido
Así se comportan los oxácidos y los hidrácidos:
Ejemplos:
H 2 S O 4 = 2 H + + SO4 –2
Ácido sulfúr ico Anión sulf ato (1)
Observar como la denominación del ácido se transforma para el anión
oso _____________> ito
ico _____________> ato
H 2 S = 2 H + + S –2
Ácido sulf hídrico Anión sulf uro
Observar como la denominación del ácido se transforma para el anión
hídrico ___________> uro
BASES son sustancias de fórmula general BOH que se disocian en agua liberando el ión hidroxilo.
H20
BOH = B + + OH –
base catión de la base ión hidroxilo
Así se comportan los hidróxidos:
Ejemplo:
u ( O H ) 2 = Cu+2 + 2 OH -
catión cúprico (1)
- Anión es un ión de carga negativa y Catión es un ión de carga positiva. Los nombres provienen de la Electroquímica
LAS SALES ( RESULTADO DE LA REACCION DE ACIDOS + BASES)
OXÁCIDOS + BASES = SAL + AGUA
m H+12 N+n2 O-2n+1 + 2 M+m ( O H )- m = M+m2 ( ( N+n2 O-2n+1 ) –2)m + 2m H2O
HIDRÁCIDOS + BASES = SAL + AGUA
m H+1n N – n + n M+m ( O H )– m = M+mn N – nm + mn H 2 O
LOS HIDRUROS ( IONES METALICOS CON IONES HIDRUROS)
M0 + m /2 H02 = M+m H -m
Unidad 5
EL ENLACE QUÍMICO
El enlace químico es la fuerza que une a los átomos para formar las moléculas. Como ya se ha dicho es un proceso de estabilización por interacciones electrónicas donde cada átomo trata de alcanzar la configuración electrónica del gas noble más cercano. Por lo general los gases nobles tienen 8 electrones de valencia, de allí se acostumbra a decir que el enlace químico se forma cumpliendo la "regla del octeto".
La energía de estabilización se denomina también la energía de enlace y corresponde además de la energía liberada cuando se forma el enlace a la energía necesaria para romper el enlace.
TIPOS DE ENLACES Y POLARIDAD DE LOS ENLACES
Existen dos mecanismos para cumplir la regla del octeto.
a. ENLACE IONICO. Cesión de electrones, de parte de un átomo fuertemente electropositivo a otro fuertemente electronegativo. Formación de iones positivos y negativos y atracción electrostática entre ellos.
b. ENLACE COVALENTE. Compartición de parejas de electrones entre átomos de parecida o igual electronegatividad. Electrones compartidos con spines opuestos y atracción magnética.
Ejemplos de estas situaciones, donde se muestra la estructura electrónica a nivel molecular, se dan a continuación mediante las correspondientes notaciones de Lewis.
TIPOS DE UNIONES
Los gráficos siguientes además de reforzar los conceptos de orbitales moleculares enlazantes y antienlazantes y sus implicancias desde el punto de vista de la energía nos muestran dos situaciones que apuntan más bién al tipo de orbitales que intervienen o a distintas formas de unión.
Unión s (sigma)
Unión p (pi)
TIPOS DE ENLACES Y UNIONES